Mole2
Historiquement
- Le concept de mole est introduit dans les sciences physiques, et particulièrement la chimie car elles utilisent un grand nombre de particules (atomes, molécules,..). Effectivement, une molécule d'eau est environs un million de fois plus petit que l'épaisseur d'un cheveu, donc si l'on considère quelques gouttes d'eau, on a déjà une énorme quantité de particules, d'où la nécessité de travailler avec une échelle plus adaptée, la mole.
- Cependant, cette unité de base très pratique n'est inclue dans le système international que depuis 1969. Depuis cette date et jusqu'en 2018, la mole était définie autrement : le nombre d'atomes présents dans 12 grammes de carbone 12.
Quantité de matière
Lorsque l'on parle de la "quantité de matière" d'une substance , il convient de remplacer le mot "matière" par l'élément considéré, car la mole en soit ne désigne qu'un nombre de particules, et possédera des caractéristiques différentes selon la substance (atome, molécule). De ce fait, on introduit une grandeur appelée masse molaire, propre à la substance, qui correspond à la masse d'une mole de cette substance. Ainsi on peut calculer le nombre de moles d'un substance que l'on a avec la formule suivante: [math]\displaystyle{ n=\frac{m}{M} }[/math] où [math]\displaystyle{ n }[/math] est le nombre de moles, [math]\displaystyle{ m }[/math] la masse totale de la substance, exprimée en grammes, et [math]\displaystyle{ M }[/math] la masse molaire du composé, exprimée en grammes par mol ([math]\displaystyle{ g.mol^{-1} }[/math]).
Classification des éléments
Le tableau périodique
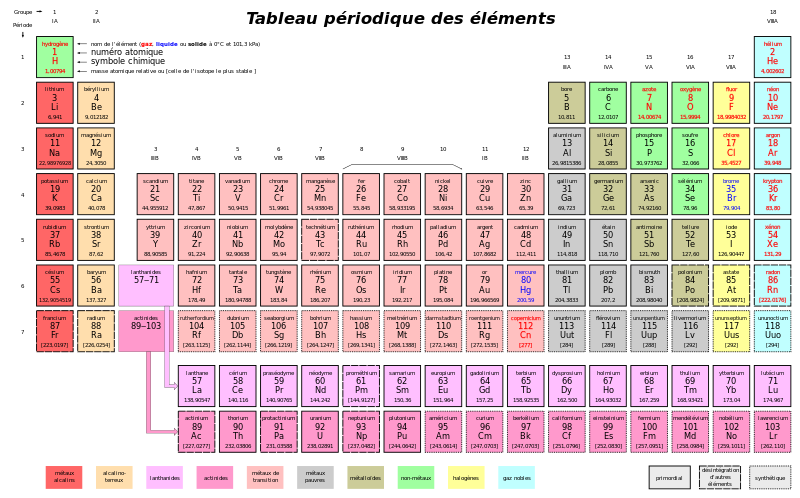
Dans le tableau périodique, comme celui que l'on peut voir ci-dessous, la masse atomique est indiquée. La masse atomique correspond à la masse d'un atome, mesurée en unités de masse atomique (u.m.a. ou u). L'unité de masse atomique est la plus proche possible de la masse d'un nucléon unique.
La valeur de la masse d'une mole d'un élément exprimée en grammes, c'est-à-dire de la masse molaire, est la même que la masse atomique du même élément exprimée en u.m.a.
Représentation des éléments chimiques
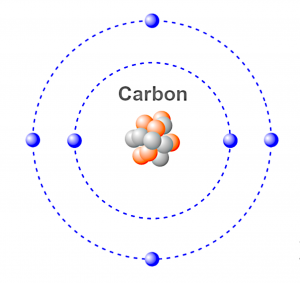
- Un atome est composé d'un noyau autour duquel "gravitent" des électrons, chargés négativement. Le noyau est lui-même composé de protons, chargés positivement, et de neutrons. Ce sont les protons et les neutrons qui donnent sa masse à l'atome, la masse des électrons est négligeable. On représente les éléments chimiques de la manière suivante: [math]\displaystyle{ _{Z}^{A}\textrm{X} }[/math]
- [math]\displaystyle{ Z }[/math] représente le nombre de protons, aussi appelé numéro atomique. C'est ce nombre qui caractérise les éléments chimiques. Par exemple, l'hydrogène possède 1 proton,le carbone en possède 6. Un atome étant électriquement neutre, à chaque proton correspond un électron. C'est donc le numéro atomique qui détermine la structure électronique de l'atome et donc les propriétés chimiques de l'élément.
- [math]\displaystyle{ A }[/math] représente le nombre de masses, ou le nombre de nucléons. Le terme nucléon regroupe les protons et les neutrons. Pour un même élément, le nombre de neutrons peut varier. Des atomes qui ont le même nombre de protons mais pas le même nombre de nucléons s'appellent des isotopes. Par exemple, le carbone 12 et le carbone 14 sont des isotopes du carbone: les deux possèdent 6 protons, mais le carbone 12 possède 6 neutrons tandis que le carbone 14 en possède 8.
La masse molaire d"un élément est très voisine du nombre de masse de l'isotope le plus abondant.
- [math]\displaystyle{ X }[/math] est le symbole de l'élément: le symbole de l'hydrogène est H, celui du carbone C...
Ainsi, à titre d'exemple, le carbone 12 est représenté de la manière suivante: [math]\displaystyle{ _{6}^{12}\textrm{C} }[/math]
Mesurer la quantité de matière
La quantité de matière, notée n est la grandeur dont la mole est l'unité. Elle se mesure de façon différente si la substance que l'on étudie est solide, liquide, gazeuse (sous forme de vapeur), ou dissoute dans une solution.
Bibliographie/Webographie
- HECHT, Eugene. Physique. Traduction de la 1ère édition américaine. éd. De Boeck Université, 1999. 1304 p. ISBN 2-7445-0018-6
- Brochure du BIPM (bureau intenational des poids et mesures) [Consulté en juin 2021] : https://www.bipm.org/documents/20126/41483022/SI-Brochure-9.pdf/fcf090b2-04e6-88cc-1149-c3e029ad8232
- Site web de futura sciences. La mole. [En ligne, Consulté en juin 2021] : https://www.futura-sciences.com/sciences/definitions/physique-mole-358/