« Kilogramme » : différence entre les versions
m (→De l'eau pour le kilogramme : correction d'une faute) |
(densité maximale de l'eau) |
||
| Ligne 9 : | Ligne 9 : | ||
C'est lors de la création du système métrique, dans les années 1790, que le kilogramme a été redéfini en France à partir de l'eau. Une des difficultés rencontrées est qu'un même volume d'eau a une masse différente suivent la température. En effet, l'eau se dilate avec la chaleur et se condense avec le froid. | C'est lors de la création du système métrique, dans les années 1790, que le kilogramme a été redéfini en France à partir de l'eau. Une des difficultés rencontrées est qu'un même volume d'eau a une masse différente suivent la température. En effet, l'eau se dilate avec la chaleur et se condense avec le froid. | ||
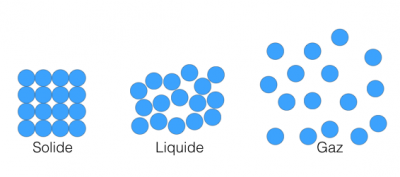
Il a donc été décidé de choisir comme référence l'état de densité maximale de l'eau, c'est-à-dire le point où l'eau est la plus dense. Cet état est atteint à environ 4°C.{{Note|Pourquoi la densité maximale de l'eau est atteinte à 4°C et pas à 0°C?}} | Il a donc été décidé de choisir comme référence l'état de densité maximale de l'eau, c'est-à-dire le point où l'eau est la plus dense. Cet état est atteint à environ 4°C.{{Note| Pourquoi la densité maximale de l'eau est atteinte à 4°C et pas à 0°C? <br>[[File:S-L-G.png|thumb | 400px|left|Etats solide, liquide et gazeux de la matière. <br>Dans l'état solide, les molécules sont bien ordonnées et très proches les unes des autres. Dans l'état solide, les molécules sont désordonnées et peuvent bouger les unes par rapport aux autres, mais restent proches. Dans l'état gazeux, les molécules peuvent bouger rapidement dans toutes les directions et tendent à prendre le plus d'espace possible.]] Avez-vous déjà mis une bouteille pleine d’eau au réfrigérateur pour la nuit? Si oui, alors vous avez eu la mauvaise surprise de la retrouver explosée. En effet, l’eau solide (la glace) prend plus de place que l’eau liquide. Pour la plupart des autres corps, c’est le contraire: l'état solide est plus dense que l'état liquide, et l'état liquide est plus dense que l'état gazeux. En effet, à pression constante, la matière devient de plus en plus dense lorsque la température diminue: les molécules se rapprochent les unes des autres, comme les manchots qui se serrent les uns contre les autres pour se protéger du froid. Plus les molécules sont serrées les unes aux autres, moins elles occupent de place, donc plus la densité de molécule est importante. <br> Il semble donc logique que le maximum de densité pour un liquide soit atteint juste avant qu'il ne se solidifie. Or on sait que l'eau gèle à 0°C: le maximum de densité de l'eau devrait donc être atteint à 0°C! <br> Mais ce n'est pas ce que l'on observe: lorsqu'on refroidit de l'eau liquide, sa densité augmente jusqu'à ce que la température atteigne environ 4°C. Et entre 4°C et 0°C, sa densité va diminuer! A 0°C, l'eau gèle, et prend plus de place que lorsqu'elle était liquide. D’où l’explosion de la bouteille! <br> <br> Cette anomalie est due à des ponts qui se forment entre les molécules, les '''liaisons hydrogènes'''. Des chaines de molécules vont alors se former, et la même quantité d'eau occupe plus de place dans l'état solide que dans l'état liquide.}} | ||
Ainsi, la référence n'est pas liée à la température mais à un changement d'état. | Ainsi, la référence n'est pas liée à la température mais à un changement d'état. | ||
| Ligne 22 : | Ligne 22 : | ||
Le kilogramme est la seule unité du système international à être encre définie à partir d'un étalon. | Le kilogramme est la seule unité du système international à être encre définie à partir d'un étalon. | ||
==Vers une nouvelle définition== | |||
==Bibliographie/Webographie== | ==Bibliographie/Webographie== | ||
Version du 28 juin 2016 à 09:46
|
|
De l'eau pour le kilogramme
L'idée d'utiliser de l'eau pour définir l'unité de masse vient des babyloniens, pour qui un gramme était le poids d'un volume d'eau pure de la taille d'un cube d'un centimètre de côté.
C'est lors de la création du système métrique, dans les années 1790, que le kilogramme a été redéfini en France à partir de l'eau. Une des difficultés rencontrées est qu'un même volume d'eau a une masse différente suivent la température. En effet, l'eau se dilate avec la chaleur et se condense avec le froid.
Il a donc été décidé de choisir comme référence l'état de densité maximale de l'eau, c'est-à-dire le point où l'eau est la plus dense. Cet état est atteint à environ 4°C.
Ainsi, la référence n'est pas liée à la température mais à un changement d'état.
En 1799, le kilogramme a été défini comme la masse d'un décimètre cube (soit un litre) d'eau pure à son maximum de densité.

Etalon international
En 1889, lors de la première Conférence Générale des Poids et Mesures (CGPM), le prototype international devient l'unité de masse. Il s'agit d'un cylindre fait d'un alliage de platine et d'iridium, comme le mètre étalon présenté au même moment. 40 copies sont réalisées à Londres et distribuées aux différentes nations.
Le prototype international est conservé au Pavillon de Breteuil, à Sèvres, et n'est jamais utilisé pour modifier le moins possible sa masse.
Le kilogramme est la seule unité du système international à être encre définie à partir d'un étalon.
Vers une nouvelle définition
Bibliographie/Webographie
Histoire universelle de la mesure, Franck Jedrzejewski, 2002
Le mètre du monde, Denis Guedj, 2000
Physique, Eugene Hecht, 1999