Mole
On peut calculer le nombre de moles d'un substance que l'on a avec la formule suivante: [math]\displaystyle{ n=\frac{m}{M} }[/math] où [math]\displaystyle{ n }[/math] est le nombre de moles, [math]\displaystyle{ m }[/math] la masse totale de la substance, exprimée en grammes, et [math]\displaystyle{ M }[/math] la masse molaire du composé, exprimée en grammes par mol ([math]\displaystyle{ g.mol^{-1} }[/math]).
|
|
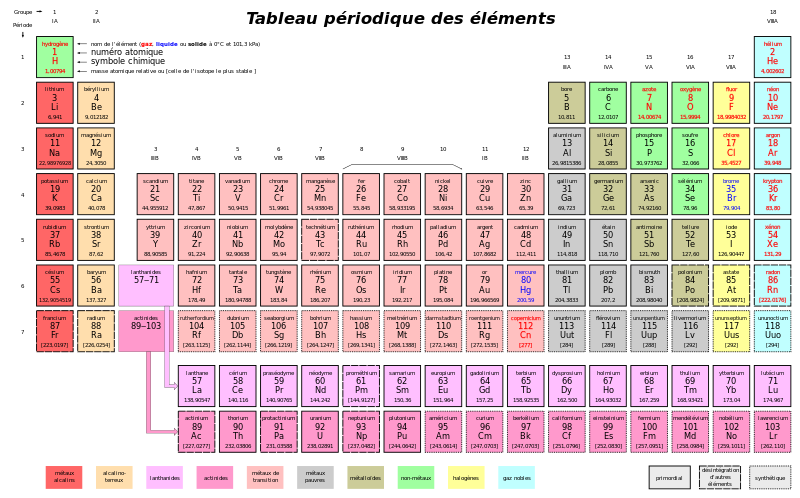
Dans le tableau périodique, comme celui que l'on peut voir ci-dessous, la masse atomique est indiquée. La masse atomique correspond à la masse d'un atome, mesurée en unités de masse atomique (u.m.a. ou u). L'unité de masse atomique est définie ainsi: 12u.m.a. correspondent à la masse d'un atome de carbone 12.
La valeur de la masse d'une mole d'un élément exprimée en grammes, c'est-à-dire de la masse molaire, est la même que la masse atomique du même élément exprimée en u.m.a.
Pour aller plus loin
Dimitri Mendeleiev - Classer les éléments sans les comprendre - e-penser (20min)
Bibliographie/Webographie
Résolution 3 de la 14e CGPM (1971)
Physique, Eugene Hecht, 1999