Acidité d'une solution
{{En bref : Le potentiel hydrogène, ou pH, est une mesure de l'acidité d'une solution aqueuse. Une valeur inférieure à 7 indique une solution acide, une valeur supérieure à 7 indique une solution basique et une valeur égale à 7 représente une solution neutre. Plusieurs méthodes existent pour mesurer le pH. Les indicateurs colorés, tels que le papier pH, permettent une mesure simple mais peu précise. Ces indicateurs changent de couleur en fonction de l'acidité de la solution, mais les variations subtiles peuvent être difficiles à détecter visuellement. Une méthode plus précise est l'utilisation du pH-mètre, qui mesure des variations de potentiel électrique. Le pH-mètre, composé d'une électrode de verre sensible aux ions H+, convertit ces variations en une valeur de pH grâce à la formule de Nernst. Cette approche fournit une mesure rapide et précise du pH d'une solution.}}
Comment mesure-t-on le pH ?
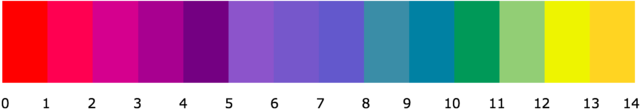
Le pH désigne le potentiel hydrogène, c'est-à-dire la concentration de protons H+ contenus dans une solution aqueuse. On dit qu'une solution est acide lorsqu'elle à un pH inférieur à 7, basique lorsque son pH est supérieur à 7, et neutre lorsque son pH est égal à 7.
Le pH peut se mesurer de plusieurs façons. Une première méthode simple mais peu précise consiste à utiliser des indicateurs colorés comme le papier pH. Il existe deux types d'indicateurs colorés : des papiers tests, qui changent de couleur lorsqu'on y dépose un échantillon de solution, et les liquides tests qui changent la couleur de la solution dans laquelle on les ajoute.
Indicateurs colorés
Le papier pH est composé de molécules qui ont la faculté de changer de couleur en fonction de l'acidité d'une solution. Cette propriété est appelée halochromisme. Ainsi, ce type de molécules permet d'estimer le pH d'une solution. Il est important de noter que cette méthode est peu précise car les faibles variations de couleurs ne sont pas détectées facilement par l'œil. Le papier pH est accompagné d'une échelle de couleurs permettant de déterminer approximativement le pH par comparaison à l'œil nu.
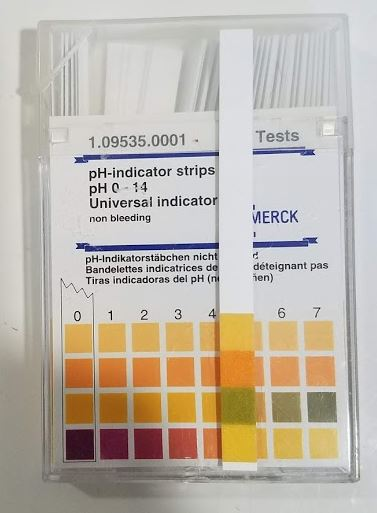
Les indicateurs colorés peuvent être des molécules naturelles. Par exemple, le chou rouge possède un indicateur coloré naturel : la flavine, une molécule anthocyanique qui est violette dans une solution de pH neutre. Si on met cette molécule dans un milieu acide, elle devient rouge, tandis qu'elle passe au vert bleuté dans un milieu basique.

Le pH-mètre
Le pH-mètre est un instrument permettant de mesurer rapidement et précisément le pH d'une solution. Son principe de fonctionnement repose sur l'utilisation d'une électrode de verre destinée à mesurer des différences de potentiel lorsqu'elle est plongée dans une solution.
L'électrode de verre est composée d'un bulbe en verre spécial, sensible aux ions H+ et rempli de chlorure de potassium. Lorsque cette électrode est plongée dans une solution test, les ions H+ présents à la fois dans la solution test et le chlorure de potassium forment une couche des deux côtés de la paroi en verre du bulbe : c'est la « couche de gel ».
On utilise également un système de référence, présent dans l'électrode, généralement rempli d'une solution électrolytique stable qui fournit un potentiel constant et connu. Cela permet d'avoir un point de référence fixe pour toutes les mesures.

Lorsque la concentration d'ions H+ à l'extérieur du système de mesure (c'est-à-dire dans la solution testée) diffère de celle à l'intérieur du système de mesure (à l'intérieur du bulbe en verre), il y a un déséquilibre. Pour rétablir cet équilibre, des réactions chimiques se produisent à la surface de la paroi en verre, et des ions H+ peuvent être libérés ou captés. Par exemple, s'il y a moins d'ions H+ à l'extérieur, certains ions H+ de la couche de gel interne du bulbe sont libérés dans le chlorure de potassium du bulbe. Pour retrouver un équilibre, de nouvelles réactions chimiques s'effectuent et l'électrode libère des électrons.
Ce processus entraîne des variations du potentiel électrique entre le système de mesure et le système de référence de l'électrode. Ces variations de potentiel sont ensuite converties en une valeur de pH par le circuit électronique du pH-mètre.
Une formule a été établie pour mettre en lien la différence de potentiel E avec le pH : la loi de Nernst.
La loi de Nernst
La loi de Nernst est une équation qui donne le potentiel chimique d'un couple oxydant/réducteur à l'équilibre d'une réaction chimique.
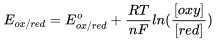
À partir de l'équation de Nernst, on relie le pH de la solution à la variation de potentiel entre l'électrode de verre et l'électrode standard de référence, à des constantes près : ΔE = a.(pHéchantillon - pHréférence) + b
Il est important d'étalonner le pH-mètre avec des solutions tampons avant la première mesure pour déterminer les constantes a et b. Une fois ces deux valeurs établies, on peut mesurer le pH de n'importe quel échantillon.
Une solution tampon est une solution qui a un pH fixe et bien connu. Ce pH reste approximativement constant même si l'on ajoute une faible quantité d'une solution acide ou basique. Cette caractéristique est donc utile pour l'étalonnage d'un pH-mètre.
Pour aller plus loin
- Indicateurs de pH (Wikipédia)
- Teintes sensibles : les indicateurs colorés de pH (PDF, dossier d'Antoine Delon)
- Indicateur coloré, dont le chou rouge (cours de chimie en ligne)
- Les électrodes utilisées en pH-métrie (cours de Frédéric Marsal, Université de Toulon)
- Fonctionnement de l'électrode du pH-mètre (vidéo explicative en anglais, sur YouTube)