« Mole » : différence entre les versions
Aller à la navigation
Aller à la recherche
(éléments chimiques et table périodique) |
(suppression caractérisation des éléments (paragraphe toujours dans la discussion)) |
||
| Ligne 6 : | Ligne 6 : | ||
On peut calculer le nombre de moles d'un substance que l'on a avec la formule suivante: <math>n=\frac{m}{M}</math> où <math>n</math> est le nombre de moles, <math>m</math> la '''masse totale''' de la substance, exprimée en grammes, et <math>M</math> la '''masse molaire''' du composé, exprimée en grammes par mol (<math>g.mol^{-1}</math>). | On peut calculer le nombre de moles d'un substance que l'on a avec la formule suivante: <math>n=\frac{m}{M}</math> où <math>n</math> est le nombre de moles, <math>m</math> la '''masse totale''' de la substance, exprimée en grammes, et <math>M</math> la '''masse molaire''' du composé, exprimée en grammes par mol (<math>g.mol^{-1}</math>). | ||
{{Note|''' | {{Note|La '''masse molaire''' d'un élément est la masse d'une mole de cet élément. }} | ||
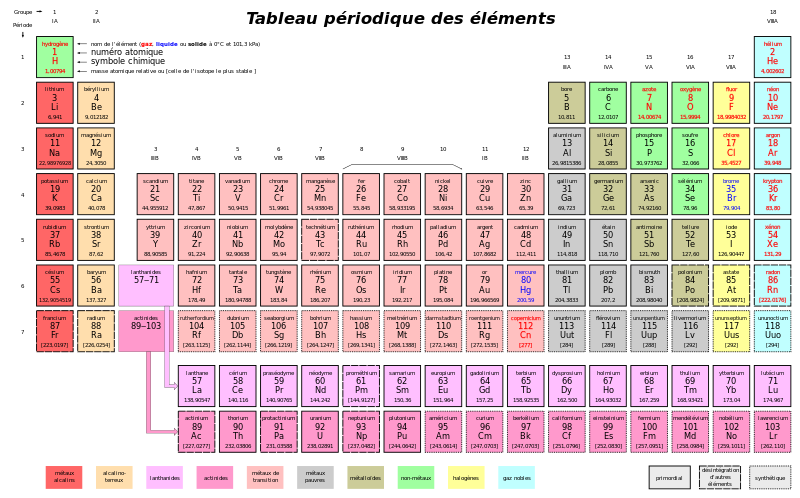
{{Note|Le '''tableau périodique''', aussi appelée '''table de Mendeleiev''' ou '''classification périodique des éléments''', est un tableau qui classe tous les éléments chimiques, ordonnés par numéro atomique croissant et organisés en fonction de leurs propriétés chimiques.[[File:Tableau_periodique.png|frame|center|Classification périodique des éléments]] }} | {{Note|Le '''tableau périodique''', aussi appelée '''table de Mendeleiev''' ou '''classification périodique des éléments''', est un tableau qui classe tous les éléments chimiques, ordonnés par numéro atomique croissant et organisés en fonction de leurs propriétés chimiques.[[File:Tableau_periodique.png|frame|center|Classification périodique des éléments]] }} | ||
Version du 29 juin 2016 à 14:51
On peut calculer le nombre de moles d'un substance que l'on a avec la formule suivante: [math]\displaystyle{ n=\frac{m}{M} }[/math] où [math]\displaystyle{ n }[/math] est le nombre de moles, [math]\displaystyle{ m }[/math] la masse totale de la substance, exprimée en grammes, et [math]\displaystyle{ M }[/math] la masse molaire du composé, exprimée en grammes par mol ([math]\displaystyle{ g.mol^{-1} }[/math]).
|
|
Pour aller plus loin
Dimitri Mendeleiev - Classer les éléments sans les comprendre - e-penser (20min)
Bibliographie/Webographie
Résolution 3 de la 14e CGPM (1971)
Physique, Eugene Hecht, 1999